
Esse é o F. Griffith
 Este é o Oswald Avery
Este é o Oswald Avery Blog com o objetivo de descrever e analisar os meus resultados. um espaço para eu escrever livremente sobre meu estágio, conversas de corredor, enfim, organizar as confusas idéias que ficam na minha cabeça.

Esse é o F. Griffith
 Este é o Oswald Avery
Este é o Oswald Avery  "Seu Freezer" descongelado, pronto para o verão
"Seu Freezer" descongelado, pronto para o verão Juliana com a mão na massa!
Juliana com a mão na massa! Na sexta última (1), fomos eu e Ju para Angra enfrentar os coquilles (Nodipecten nososus, família Pectinidade). Eu, especialista em puncionar hemolinfa do músculo, fui junto para fazer o trabalho e ajudar a Ju no mestrado dela. E ela retirou as brânquias, glândula digestiva e músculo (e que músculo!)
Na sexta última (1), fomos eu e Ju para Angra enfrentar os coquilles (Nodipecten nososus, família Pectinidade). Eu, especialista em puncionar hemolinfa do músculo, fui junto para fazer o trabalho e ajudar a Ju no mestrado dela. E ela retirou as brânquias, glândula digestiva e músculo (e que músculo!)
Imagem do coquiles aberto. A parte branca na imagem é o músculo que fecha as valvas; a parte laranja são as brânquias.
Eu e a Ju abrimos mão do nosso almoço (o Petrus e o Carlos, que nos levou até lá almoçaram enquanto trabalhávamos) para voltarmos logo na sacolejante e barulhenta kombi, percorrendo as sinuosas pistas daquela região. Não me aguentei: dormi em cima da minha mochila e só acordei já na Av. Brasil. Pensava que a hemolinfa não tinha sido suficiente, que a Ju não conseguiria extrair quase nada de RNA... e qual não foi nossa surpresa, ao chegarmos no lab, que havia uma "maçaroca" branca decantada no falcon! Isto muito provável é sinal de hemócitos, e a Ju havia me falado antes que aconteceu o mesmo com os hemócitos das ascídias da Cíntia, de tanta célula que havia.
Como já estávamos enjoadas de carro, era sexta feira e nem brincando queríamos pegar a Av. Brasil, fomos embora de barca. Melhor balançar de outro jeito...
Ah, mais algumas informações sobre o projeto e o coquilles, clique aqui.

Ainda bem que, por sorteio, fomos o primeiro grupo a ver as lâminas, o que significa que saímos mais cedo. O que não significa que cheguei em casa mais cedo, pois o Madureira demorou horrores, ficamos eu e a Tati esperando no ponto, a Av. Brasil parada... E chegar em casa também não significa descansar, pois amanhã é o último dia e o dia da apresentação do seminário. Medo! rs
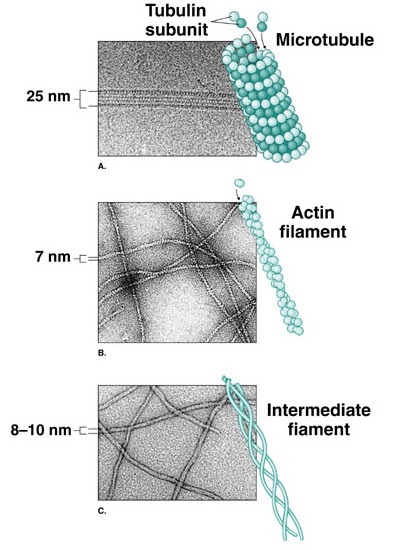
Componentes do citoesqueleto: microfilamentos de actina, microtúbulos e filamentos intermediários. À esq. imagens em MET.

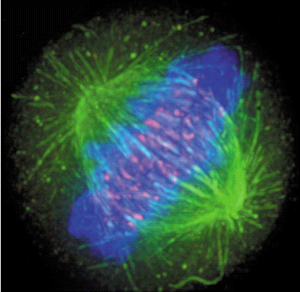
Marcação por fluorescência. Em vermelho: actina; em verde: microtúbulos; em azul: núcleo

L-15 em pó (esq) e o de garrafa (dir)
 E depois de pescados os cortes, as grades vão para o...porta-grades. Uma caixinha com vários buraquinhos numerados para guardar os cortes até a hora de usarmos...
E depois de pescados os cortes, as grades vão para o...porta-grades. Uma caixinha com vários buraquinhos numerados para guardar os cortes até a hora de usarmos...
Não sei se o Rupert Lee, autor do livro, foi, digamos, dramático demais, mas quando li o texto (após fazer o post abaixo) me deu uma vontade louca de postar aqui. Quando li, até eu fiquei com raiva do Fisher. Mas fazer o quê, ele ia advinhar? Imagina cada um de nós perdendo tempo em analisar cada resíduo produzido em nossos experimentos? rs E também fiquei imaginando, "será que ele soube? Como deve ter se sentido?"
...e espero que eu não seja acusada de cópia ilegal. Esse trecho é menos que 10% da obra!

" O acaso só favorece aos espíritos preparados e não prescinde da observação".


Meio de cultura Leibovitz L-15
E papeando pelo msn com a Ju, ela continuou investindo q o problema era o pH, e realmente é o que parece ser. Até q ela perguntou se o L15 tinha alguma substância indicadora de pH. Lembrei de um nome, e fui no site da invitrogen para lembrar: phenol red. Bastou uma procurada no Oráculo para descobrirmos que essa substância é... um indicador de pH!!! E advinha que cor fica quando o pH se torna ácido???
Juntando essa informação com a do artigo... (me senti agora um Watson&Crick juntando os dados da Rosalind Franklin e fazendo a descoberta do século!). Uma boa justificativa que responde às indagações do post anterior, de porque que as céls (vivas, como assegurou o tripan) com ñ coram com VN, mas o ctrl, sim. Porém, outra pergunta: então por que quando eu colocava a placa na geladeira (mais ou menos 6ºC) as céls com Cd coravam (exceto 2uM)? Segundo a Ju, devido à diminuição da fluidez da membrana. Mas isso pra mim ainda não está claro.
Outro questionamento: o L-15 não deveria ter um tampão?! Ó o que ta escrito no site da invitrogen, sobre o L-15: “L15 formulations were developed without a sodium bicarbonate buffer system. L15 medium is buffered by phosphates and free-base amino acids (L-arginine primarily, but also L-histidine and L-cysteine)”. Será que o Cd acaba ultrapassando a “faixa de tamponamento”?
Enfim, agora é arrumar um jeito de corrigir o pH do L15 com Cd (será que de amarelo vai ficar vermelho/rosa novamente)?.
E Ju, só pra deixar público, muitíiiiiiiiiiiiiiiiissimo obrigada pela força. Toda semana essa menina me dá um artigo novo, e artigo dos bons! Fico até com vergonha de não procurar direito hehehhe
 Calma gente. Antes de saírem detonando meu blog, leiam este post até o fim (pelo amor de Deus, não é nada sobre as atrocidades que ele cometeu!!!).
Calma gente. Antes de saírem detonando meu blog, leiam este post até o fim (pelo amor de Deus, não é nada sobre as atrocidades que ele cometeu!!!). 
ô mauro...lembra destas fotos? agora virou vídeo... parece aqueles videozinhos de céls q tem no CD do the cell, mas esse é muito mais legal..acho que vou levar um laptop pro congresso pra mostrar lá! Vai ser sucesso!!! no ciência viva então...a Eleonora ia amar! rs
Hein... e imagina os vídeos que daria pra fazer com aquele tal "time-lapse photomicrography do artigo... ops, ainda ñ postei ele!

 Figura 1: Hemócitos em microscopia de luz e C de fase interferencial. Em A, temos a hemoblasto-like. Em B, hialinócito. Em C, granulócito. Em G, um agregado de cél, que graças a Deus ñ tenho visto muito nestas placas que ando fazendo, pois antes tinha muuuito deste tipo. quando tem, são de poucas células. em H, granulócito degranulado.
Figura 1: Hemócitos em microscopia de luz e C de fase interferencial. Em A, temos a hemoblasto-like. Em B, hialinócito. Em C, granulócito. Em G, um agregado de cél, que graças a Deus ñ tenho visto muito nestas placas que ando fazendo, pois antes tinha muuuito deste tipo. quando tem, são de poucas células. em H, granulócito degranulado. Tabela 1: resumo da microscopia de luz
Tabela 1: resumo da microscopia de luzFigura 2: Granulócitos sob luz UV
* Para citometria de fluxo:
Sobre citometria de fluxo, ele utilizou 5 individuos. Encontrou uma variabildade alta, mas pôde-se distinguiur basicamente 4 populações.
Em algumas ostras foram encontrados apenas R1 e R2, enquanto que em outras, foram encontrados todas as subpopulações. Ao observarem no microscópio, confirmou-se que R1 são granulócitos e R2, hialinócitos. Já R3 e R4 não puderam ser eficientemente classificados devido ao baixo número de células por região.
Abaixo, um resumo:

* Para Imunocitoquímica:
baixo, uma tabelinha resumida. As fotos estão bem bacanas, mas não vou adicioná-las aqui pois vai ficar imenso o post.
Tabela 3: Imunohistoquímica
Ou seja, todas as imunos deram positivas para todas as substâncias em granulócitos. Como eles fagocitam mais ativamente, há maior produção destas enzimas (fosfatase ácida, peroxidase, fenoloxidade) além de superóxido e melanina, todos envolvidos em processos de degração de corpos estranhos fagocitados por eles. Provavelmente por fagocitar menos, hialinócito deve não produzir, ou melhor, produzir quantidades muito pequenas destas enzimas.
FAGOCITANDO...
O autor viu que tanto granulócitos quanto hialinócitos tem habilidade de fagocitar, neste experimento ele utilizou o fungo C. cerevisae (péssimas lembranças...rs), sendo os granulócitos mais eficientes - teve um lá que fagocitou até 30 céls! Uma diferença interessante: os granulócitos não emitem filopódios para fagocitar ( ou então filopódios muito curtos): eles "engolfam" (verbo do artigo - engulfed) por invaginação da membrana. Já os hialinócitos emitem looongos filopódios.
Os granulócitos também encapsulam hifas (este processo ocorre qd a partícula estranha é mt maior que a célula). Alguns granulócitos ficaram em torno da hifa, e antes mesmo de ter algum contato, alguns degranularam. e no final de 40min, todos q estaavam participando do processo degranularam. No entanto, os hialinócitos pouco participaram deste processo. E também fizeram uma coloração para verificar a melanização destas cápsulas. Após uma pesquisa rápida no Oráculo - em fontes confiáveis, claro), a melanização ocorre após a ativação da cascata de fenoloxidase (PO), e este processo é uma resposta do sistema imune que também ocorre em vários outros invertebrados.
* Para TEMAgora vamos p/ parte que interessa. Na TEM, ele divide os hemócitos em váaarios subtipos (4 sub- p/ hialinócitos e 5 sub- p/ granulócitos) baseados na razão citoplasma:núcleo (C:N), formato do núcleo, se forma ou não filopódio, se tem retículo (aliás aquelas "minhoquinhas" q a cíntia tinha falado q era reciclagem de membrana tá com cara de ser retículo...) , etc. e os grânulos? OITO tipos diferentes... e o autor hipotetiza queestes diferentes tipos de hemócitos podem ser diferentes estágios de uma via de maturação destas células, ou que simplesmente são mudanças súbitas individuais - sem via nenhuma. Já os OITO tipos de grânulos, ele diz que não está claro do porquê desta diversidade, mas que é frequentemente encontrado em outros bivalves. E pode ser que cada tipo de grânulo seja especializado em uma específica via de defesa na célula.
Mas eu acho que o técnico lá da uerj tava com razão...ficou pouco contrastado, em comparação com as microfotos do artigo
That´s all, folks!

Muito bem, então a Cíntia me pediu pra procurar artigos que falavam de MET de hemócitos. Pensei “ah, deve ter de montes, especialmente de C. virginica e C. gigas, mesmo gênero que a minha rhizophorae, pois lá na Europa eles estudam bastante essas duas, e Mytilus edulis também, pois lá eles cultivam para consumo, estudam parasitas, efeitos de metais pesados e outras substâncias, expressão gênica etc etc.” qual não foi minha surpresa, ao procurar no web of science e no science direct, apareceram pouquíssimos artigos. Tentei várias palavras-chave, TEM (a tonta tinha tentado MET – Microscopia Eletrônica de Transmissão, em português, achou nadinha, só o particípio do verbo meet – met rs. O certo é Transmission Electron Microscopy, TEM), haemolymph, haemocytes, crassostrea, bivalves, todas estas palavras combinadas entre si. Nada significativo.
Até que... a Ju, minha grande amiga do lab, que divide comigo o aconchegante cafofo da 32 no underground do fundão... me passa o artigo mágico e salvador:
Sim, Saccostrea glomerata (abaixo), uma ostra que tem só lá na Austrália. Provavelmente não deve ser mais relacionada com a C. rhizophorae que as espécies do mesmo gênero, mas já é um começo (fico devendo para próximos posts uma pesquisa filogenética de ostras, pois acho interessantíssimo levar isso em conta em se tratando de comparar hemócitos, algo que até hj ñ vi em nenhum artigo. Que achas, Mauro e Sil? No início da facul ñ gostava, ou melhor, não entendia muito sobre, mas agora...hehe). E o trabalho é bom, eles fazem muitas coisas que vou explicar melhor no próximo post (estou preparando uma resenha do artigo). Até estava comentando com o Pablito, que o trabalho não é conclusivo, mas abre uma gama de possibilidades e boas idéias. E ele é novíssimo, saiu no início do ano passado.
